科研服务
立足于生命科学,为基础研究领域科学工作者提供生物学高端技术服务
科研服务
相关产品

- 产品描述
-
服务简介
南京瑞源生物基于CRISPR-Cas12a技术推出酵母基因编辑服务(包含单基因敲除、多基因敲除、基因插入)。与传统的TALEN(转录激活子样效应物核酸酶)以及ZNF(锌指核酸酶)技术相比,CRISPR-Cas12a技术能够实现更高效更灵活的基因编辑。
技术原理
CRISPR/Cas12a系统实现基因组编辑主要通过识别、切割和修复三个步骤完成。首先,CRISPR序列进行转录产生pre-RNA,Cas12a自行对pre-RNA加工切割生成成熟的crRNA,crRNA通过与核酸内切酶的WED、RuvC和REC2结构域以及两个Mg2+离子的相互作用形成单核酸酶效应复合物。效应复合物首先扫描5'-TTN-3'PAM位点,之后通过碱基互补配对原则使crRNA间隔序列与目标DNA同源序列结合,将Cas12a特定靶向结合到目标位点。然后Cas12a使用RuvC核酸内切酶结构域对DNA实现远离PAM交错切割,同时将PAM远端切割产物释放,产生长度为4~5nt突出的黏性末端缺口。随后,细胞启动修复机制以修复损伤缺口。NHEJ和HDR是真核细胞内主要的DSB修复机制,NHEJ可造成移码突变使基因功能失效,部分原核细胞缺乏NHEJ,但若添加外源修复模板(一般500~1000bp左右同源臂),也可通过HDR修复实现精准的基因插入或替换。
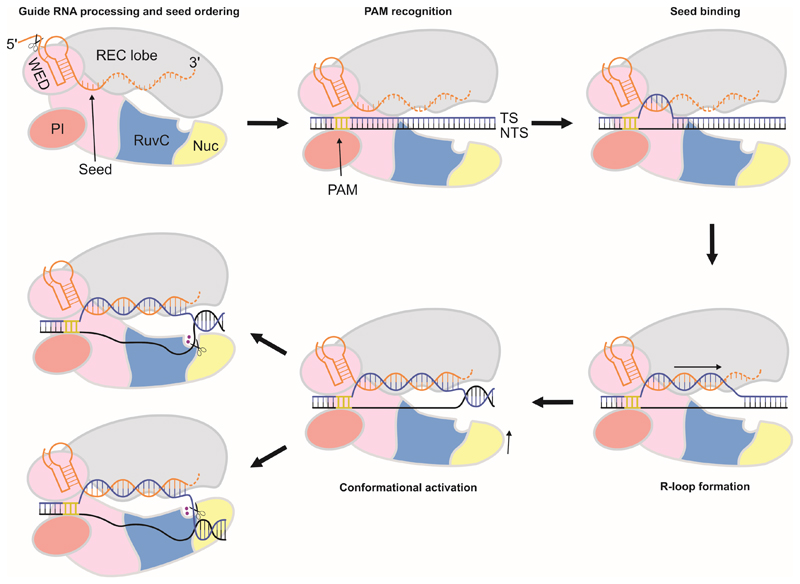
图CRISPR/Cas12a基因编辑原理
Swarts DC al et, 2017
应用领域
1、精准编辑酵母基因组中的目标基因,用于功能缺失研究。
2、构建基因编辑菌株,用于代谢工程、表型分析或药物筛选。
3、多基因协同编辑,研究基因互作或通路调控机制。
服务优势
精准编辑:基于最新Cas12技术进行酵母基因编辑,保障酵母基因编辑的准确性与重复性,降低脱靶效率。
验证服务:提供PCR验证和测序服务,确保编辑效果。
灵活设计:支持客户提供靶点序列或由我司设计sgRNA。
快速交付:使用Cas12进行酵母编辑,高效、省时、省钱,它比常规基因编辑周期缩短30-50%;同时拥有常见酵母菌株的预转化Cas12载体库,缩短构建时间。
一敲多用:可以实现从基础研究到工业菌株优化的全方位酵母基因编辑需求。
服务内容
项目
周期
步骤
交付内容
酵母基因敲除/敲入
45个工作日
1、CRISPR敲除/敲入靶点设计
2、敲除/敲入模块构建
3、载体构建
4、基因编辑
5、菌P验证
6、测序鉴定
7、阳性克隆扩增
8、结果鉴定
1、敲除/敲入成功的菌株甘油菌、平板
2、测序文件
3、电子版实验报告1份
样本要求
虚拟样品:
1、目标基因名称及ID。
2、基因编辑菌株基因组序列。
实体样品:
类型 送样标准 运输条件 酵母菌株(客户提供) 活菌数≥1×108 CFU/mL,无污染 常温,48小时内送达 质粒(sgRNA载体) 浓度≥100ng/μL,体积≥20μL 冰袋,72小时内送达 甘油菌(保存菌种) 体积≥500μL,无污染,标注抗性 干冰,1-3天(按重量分级) 平板菌 无污染 常温 结题标准
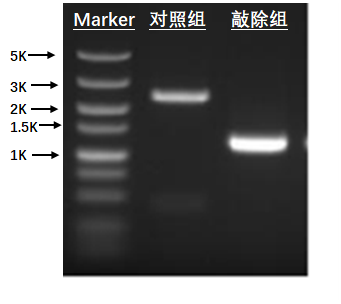
1、PCR验证目标基因编辑成功(提供电泳图)。
2、测序结果确认编辑位点无误。
3、交付基因编辑菌株及实验报告(含原始数据)。
案例展示
1、菌株表型验证图
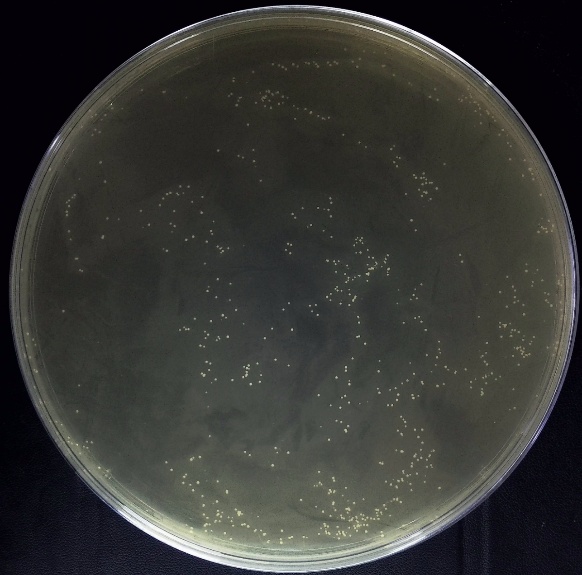
2、电转平板图
3、PCR鉴定图
4、敲除测序验证图

参考文献
- Li ZH, Liu M, Lyu XM, Wang FQ, Wei DZ. CRISPR/Cpf1 facilitated large fragment deletion in Saccharomyces cerevisiae. J Basic Microbiol. 2018;58(12):1100-1104.
- Li, Z. H., Liu, M., Wang, F. Q., & Wei, D. Z. (2018). Cpf1-assisted efficient genomic integration of in vivo assembled DNA parts in Saccharomyces cerevisiae. Biotechnology letters, 40(8), 1253–1261.
- Verwaal, R., Buiting-Wiessenhaan, N., Dalhuijsen, S., & Roubos, J. A. (2018). CRISPR/Cpf1 enables fast and simple genome editing of Saccharomyces cerevisiae. Yeast (Chichester, England), 35(2), 201–211.
- Swiat, M. A., Dashko, S., den Ridder, M., Wijsman, M., van der Oost, J., Daran, J. M., & Daran-Lapujade, P. (2017). FnCpf1: a novel and efficient genome editing tool for Saccharomyces cerevisiae. Nucleic acids research, 45(21), 12585–12598.
- Chen, B. C., Chen, Y. Z., & Lin, H. Y. (2023). An Introduced RNA-Only Approach for Plasmid Curing via the CRISPR-Cpf1 System in Saccharomyces cerevisiae. Biomolecules, 13(10), 1561.
声明:本公司出售产品只能用于科研目的,不得用于诊断或者治疗!


