3 步选对蛋白表达系统,研究效率狂飙
发布时间:
2025-02-25 16:58
来源:
蛋白质作为生命活动的核心执行者,是中心法则的最终产物,其结构与功能的复杂关系一直是生命科学研究的重点。传统天然提取法受限于样本异质性和低丰度,严重制约了蛋白质研究进程。1970年代兴起的重组蛋白表达技术为这一困境提供了突破性解决方案。
1
如何选择合适的蛋白表达系统
蛋白表达系统可以根据宿主细胞的类型,分为大肠杆菌原核表达系统,毕赤酵母真核表达系统、昆虫杆状病毒表达系统以及哺乳动物真核表达系统,选择正确的蛋白表达系统是实验成功的关键因素。
1、大肠杆菌表达系统
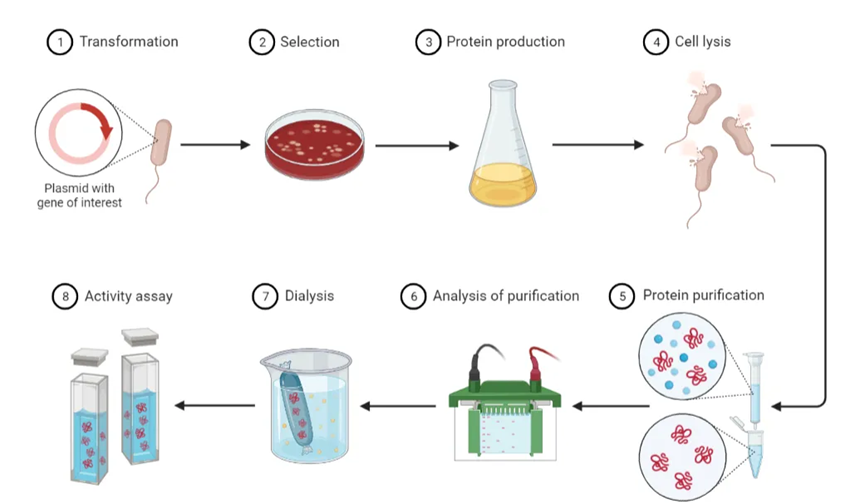
图1 大肠杆菌原核系统蛋白表达流程
大肠杆菌原核表达系统是最早也是最经济的蛋白质生产方式。它被广泛用于分子生物学和生物技术研究,包括基因克隆、蛋白质表达和生产,以及作为研究蛋白质功能的工具。
特点:
(1)快速生长:大肠杆菌能在短至20分钟的时间内完成细胞分裂,实现快速繁殖。
(2)遗传背景清楚:有多种重组载体和标签供选择、成本低、表达水平高、稳定性好、抗污染能力强。
(3)高表达量:大肠杆菌能够高效合成重组蛋白。
(4)缺乏复杂修饰:不进行复杂的翻译后修饰,如糖基化和蛋白折叠,导致大量包涵体的形成,可能需要后续的蛋白复性。
(5)内毒素:大肠杆菌是一种革兰氏阴性菌,内毒素会广泛分布于大肠杆菌细胞壁。大肠杆菌破裂释放蛋白时内毒素也会释放。
应用:
适用于结构简单、后修饰要求不高的蛋白表达。
2、毕赤酵母真核表达系统
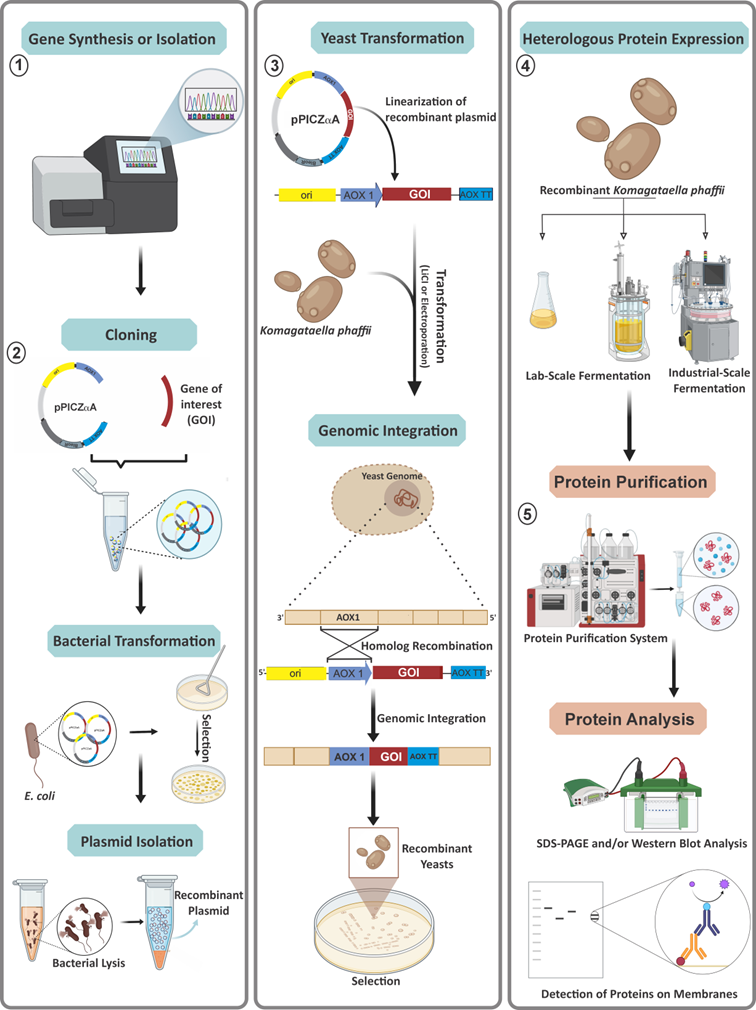
图2 毕赤酵母真核系统蛋白表达流程
酵母蛋白表达系统是一种利用酵母细胞作为宿主来生产重组蛋白的技术平台。酵母细胞是一种单细胞的真核微生物,具有许多适合蛋白质生产的有利特性,尤其是甲醇酵母,因其兼具原核和真核特性而受到青睐。
甲醇酵母是一类能够利用甲醇作为唯一碳源和能源的酵母菌,其中毕赤酵母(Pichia pastoris)因其独特的甲醇利用能力和高效的外源基因表达能力,已成为蛋白质表达和生物制药领域中的一个重要的宿主菌。
特点:
(1)蛋白翻译后修饰:具备一些真核细胞的翻译后修饰能力,糖基化机制接近高等真核生物。
(2)分泌表达:蛋白分泌效率低,需要高密度发酵,部分蛋白产物易降解,表达量不可控。
(3)稳定性:可以分泌至培养基中,便于纯化。
应用:
适用于需要一定程度翻译后修饰的蛋白质。
3、哺乳动物细胞表达系统
图3 哺乳动物细胞表达蛋白
哺乳动物细胞表达系统是一种在哺乳动物细胞中生产重组蛋白的技术平台,能够提供与人体内环境极为相似的翻译后修饰,因此产生的蛋白质在活性上更接近天然蛋白。这些系统能够提供与天然蛋白质非常相似的翻译后修饰,如糖基化、磷酸化和蛋白质折叠等,这对于许多生物药物和复杂蛋白的功能至关重要。
特点:
(1)复杂修饰:能够进行复杂的翻译后修饰,可以获得与天然蛋白的结构、修饰方式几乎完全相同的重组蛋白,对保持蛋白质生物活性具有巨大优势。
(2)表达水平:表达水平从低到中等,取决于所选用的细胞系和载体。
(3)成本:相对较高,操作技术要求高。
(4)感染:存在潜在的动物病毒污染风险。
应用:
适合表达对翻译后修饰要求严格的蛋白,如某些治疗性蛋白。
4、影响因素
针对不同的下游应用,我们需要考虑一系列因素,例如表达蛋白功能性、蛋白的可溶性、表达蛋白质速率和得率等。
功能性(Functional Compatibility)
表达系统是否适用于目标蛋白的结构和功能?某些蛋白质可能需要特定的表达系统才能正确折叠和活化。
可溶性(Solubility)
目标蛋白在表达系统中的溶解度如何?一些蛋白质可能在特定系统中更容易溶解并保持稳定性。
速度(Speed)
表达系统所需时间是否符合实验时间表?有些系统可能需要更长的时间才能产生足够量的目标蛋白。
得率(Yield)
表达系统能够产生的目标蛋白量是否足够满足实验需求?高得率的系统可以减少后续处理的成本和时间。
综上所述,我们发现表达系统的选择取决于目标蛋白的特性、所需的蛋白质产量和质量、以及实验的具体需求。例如,对于结构简单、不需要复杂修饰的蛋白,原核表达系统可能是成本效益较高的选择。而对于需要特定修饰的蛋白质,酵母或哺乳动物细胞表达系统则更为合适。
由于不同表达系统表达目的蛋白的流程不完全相同,但其中有部分实验步骤是相似的。例如:基因合成和密码子优化、表达载体构建及蛋白表达以及表达鉴定。
我们接下来详细叙述一下这些步骤。
2
实验流程
1、基因合成及密码子优化
(1)基因合成
首先要明确目的蛋白的编码基因,并考虑其特性,如剪接变体、信号序列、跨膜区域和翻译后修饰位点。
数据库搜索:使用公开的生物信息学数据NCBI,Pubmed,GeneBank,UniProt等,搜索蛋白名称,序列,基因等。
文献搜索。
基因组学数据库:Ensembl、UCSC Genome Browser 核实蛋白序列,尽量找到相对应的基因序列。
(2)密码子优化
不同的物种翻译同样一个氨基酸可能使用不同的密码子,并且因物种不同而带有密码子偏好性。尽管目前尚未得知密码子偏好性的自然形成的原因,但是这种现象对于蛋白表达效率的影响是显著的。
密码子优化是通过调整基因序列中的密码子使用,以适应宿主生物的遗传和翻译机制,从而提高目标蛋白的表达效率和产量。
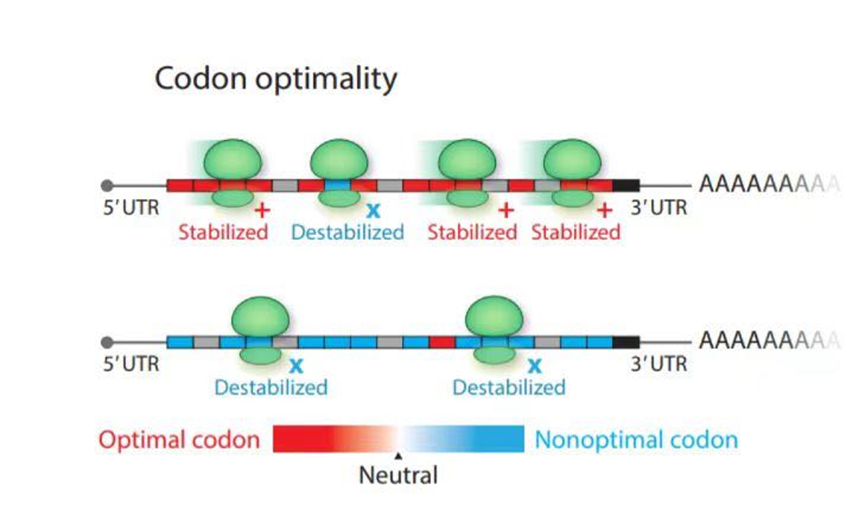
图4 密码子优化
瑞源生物目前提供基因合成和密码子优化服务,只要提供蛋白序列,就能完成密码子优化和化学基因合成并完成测序。
2、表达载体构建、转化及蛋白表达
基因合成之后就需要嵌入到表达载体(质粒)中用于蛋白的表达,而载体的选择也是多种多样的,不同的情况需要考虑不同的载体,具体的载体还需根据蛋白需求仔细甄别。
根据载体的特点以及需表达的蛋白的性质,选择合适的表达载体后,将载体引入宿主细胞进行转化。
转化方法常用的有三种:
1、电穿孔法:效率较高,整合型载体转化前要酶切线性化。
2、LiCl法:制备成感受态细胞。
3、原生质体法:去除厚壁以筛选成功转化的细胞。
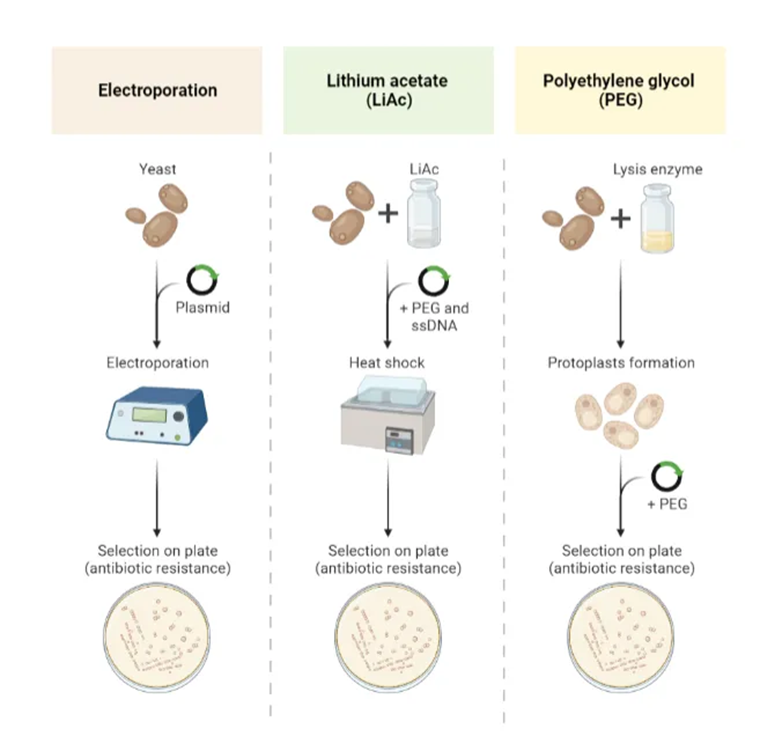
图5 载体转化
从筛选后的细胞中随机挑选几个,进行PCR验证,以确保表达载体已正确插入。对PCR阳性的菌落进行进一步的酶切分析,以确认表达载体的插入方向和完整性。将转化后的细胞在最佳条件下培养并诱导目的蛋白的表达。
3、表达鉴定
重组蛋白表达的鉴定方法可以用于确认是否成功表达了目标蛋白,并评估其表达水平和纯度。以下是几种常用的重组蛋白表达鉴定方法:
SDS-PAGE电泳分析:通过SDS-PAGE电泳可以检测蛋白是否表达以及表达的水平。将诱导前后的菌液进行比较,观察条带的变化,从而判断蛋白的表达情况。
Western印迹:使用特异性抗体对表达的蛋白进行检测,可以进一步确认蛋白的表达和大小。
酶活性分析:如果目标蛋白具有酶活性,可以通过酶活性分析来评估其表达和功能。例如,可以使用酶活性底物来测定酶活性的程度。
质谱分析:使用质谱技术分析可以确定表达的蛋白质的氨基酸序列和分子量,从而验证重组蛋白的身份。
免疫组化:使用特异性抗体对细胞或组织中的目标蛋白进行染色和可视化,以确定目标蛋白的定位和表达情况。
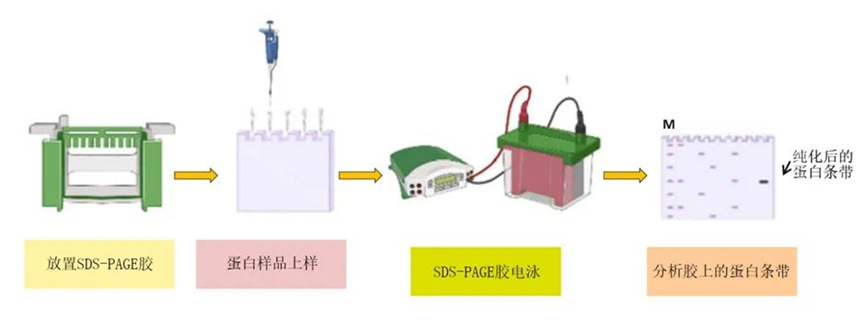
图6 SDS-PAGE电泳分析
这些方法可以单独或结合使用,以全面评估重组蛋白的表达情况和特性。具体选择哪种方法取决于目标蛋白的性质和实验条件。
3
文献案例展示
从上述的内容中我们简单认识了重组蛋白表达技术的实验流程,接下来小源通过一篇经典的文献来展示重组蛋白表达在科研中发挥的作用。
2022年发表于International Journal of Biological Macromolecules ( IF 7.7 )上一篇题为“Prokaryotic expression, purification, physicochemical properties and antifungal activity analysis of phloem protein PP2-A1 from cucumber”的研究型论文中。作者为研究该蛋白的特性,使用原核表达系统,表达韧皮部蛋白2以研究其生物活性。首先作者从黄瓜中提取并克隆了CsPP2-A1基因片段。构建了一个重组质粒pET-30a/CsPP2-A1,该质粒编码一个带有6×His标签的154个氨基酸的重组蛋白,预测分子量为18 kDa。
实验发现,重组蛋白的产量受温度影响,15 ℃时在大肠杆菌BL21中有效表达,而在37℃时主要以包涵体形式积累。通过Ni-IDA亲和色谱在500 mM的咪唑浓度下纯化了带有6×His标签的重组蛋白,而在较低的咪唑浓度下纯化效果不佳。
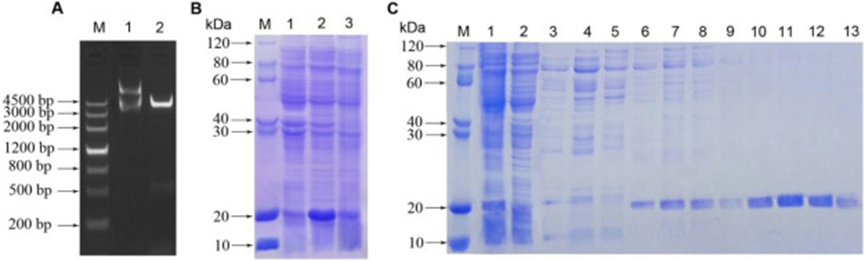
图7 pET-30a/CsPP2-A1的鉴定和SDS-PAGE分析
采用MALDI-TOF-MS技术对纯化的重组蛋白进行了鉴定。通过将SDS-PAGE分离得到的蛋白带进行处理,然后进行质谱分析,发现肽段与CsPP2-A1序列之间有55%的序列覆盖率的精确匹配,从而确认了所纯化蛋白的身份为CsPP2-A1。
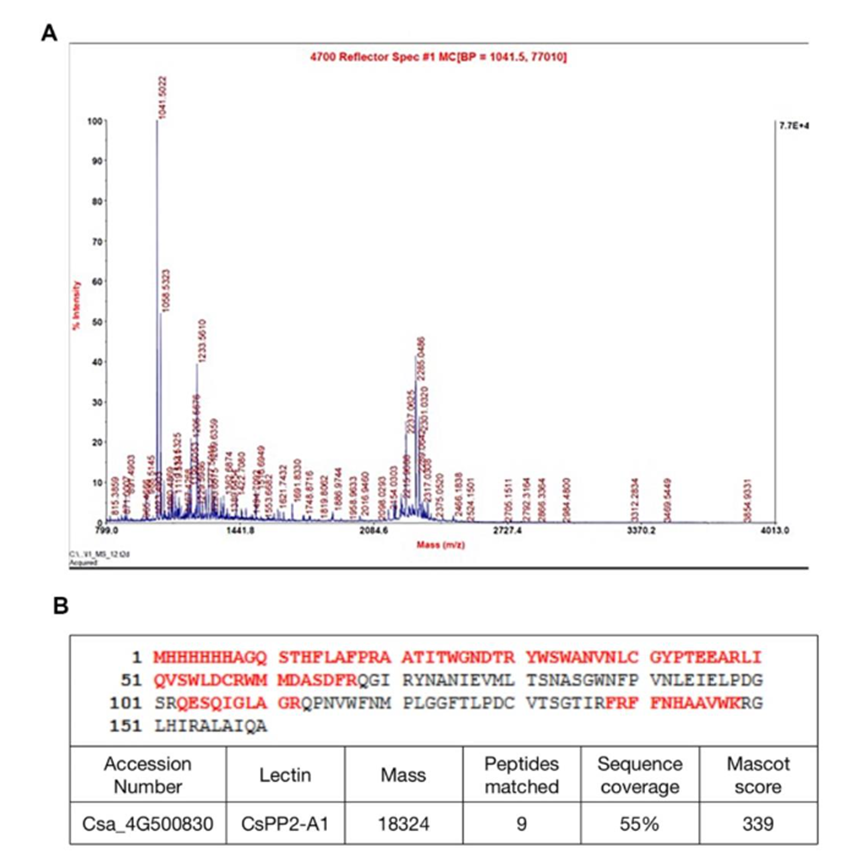
图8 CsPP2-A1蛋白的质谱检测
通过SDS-PAGE电泳,研究人员观察到一个单一的蛋白带,其分子量约为18 kDa与CsPP2-A1一致。最后通过Western blot分析得到了进一步的确认该蛋白确实是CsPP2-A1。
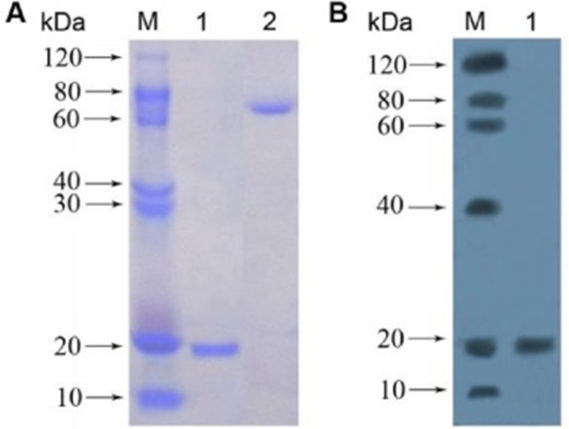
图9 纯化的CsPP2-A1重组蛋白的SDS-PAGE和Western Blot
对重组蛋白鉴定其凝集活性,发现凝集活性与天然蛋白类似、CsPP2-A1稳定性良好、CsPP2-A1可能具有壳四糖的特异性结合位点。
4
项目介绍
南京瑞源生物通过自主研发设计实验流程,不断优化培养条件和转染方法,开发了完备的蛋白表达平台,借助丰富的蛋白表达纯化鉴定经验,为蛋白研究学者提供高质量的服务内容。
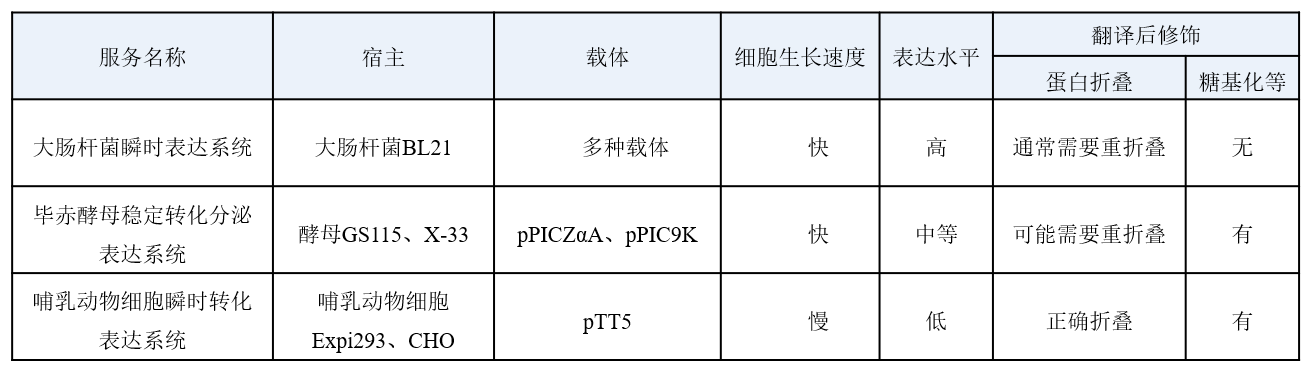
目前瑞源生物可以提供的三种蛋白表达系统如下:
大肠杆菌原核表达蛋白流程
毕赤酵母真核表达蛋白流程
哺乳动物细胞表达蛋白流程
技术参数:
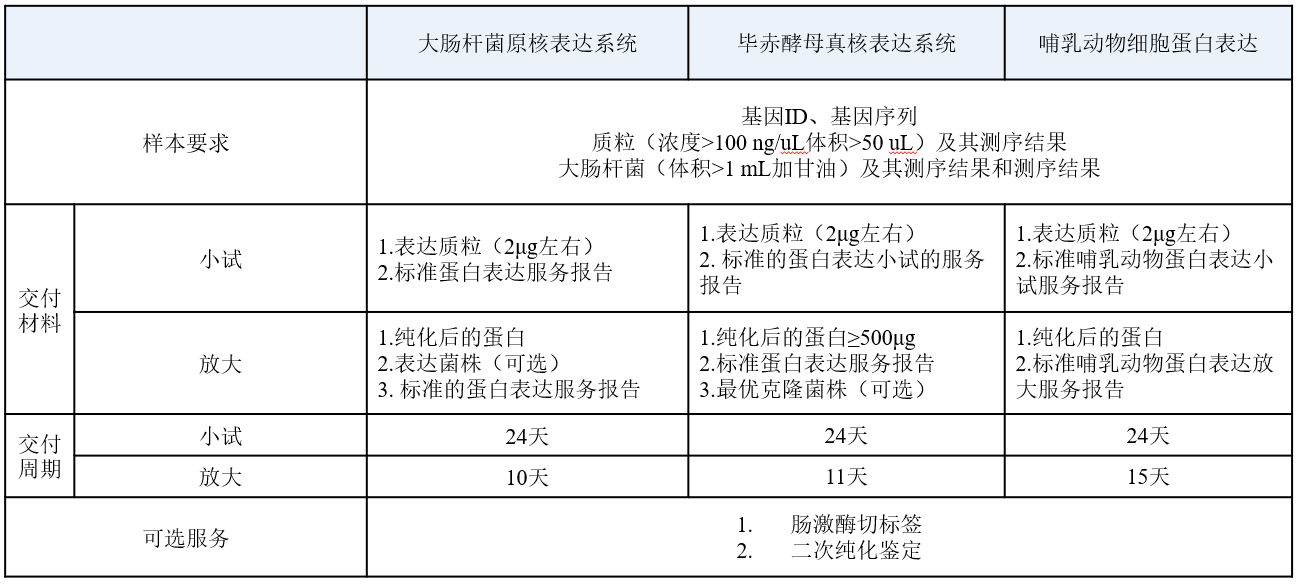
服务内容:

上一页
下一页
相关新闻
双荧光素酶报告基因是以萤火虫荧光素酶(Firefly luciferase)为报告基因,以海肾荧光素酶(Renilla luciferase)为内参基因,通过同时检测两种荧光素酶,实现对目标基因表达或分子互作的定量分析。
蛋白表达系统可以根据宿主细胞的类型,分为大肠杆菌原核表达系统,毕赤酵母真核表达系统、昆虫杆状病毒表达系统以及哺乳动物真核表达系统,选择正确的蛋白表达系统是实验成功的关键因素。

赋能科研,驱动创新
联系我们
-
电话:400-863-8520
咨询邮箱:market@bestofbest.top
投诉建议:info@bestofbest.top
地址:江苏省南京市栖霞区仙林街道齐民西路6号南京仙林智谷3C栋10楼
子公司:南京维百瑞检测技术有限公司

南京瑞源生物

官方客服


